PiCCO handler om cardiac output (CO), men oppgir også mange andre parametere. Disse tallene vekker ofte negative emosjoner, kanskje fordi de gir «information overload», skaper usikkerhet eller fordi leverandøren foreslår en behandlingsalgoritme som er potensielt farlig. Mange avfeier også disse parametrene fordi de har større tro informasjonen fra ekko. Likevel, PiCCO har en del fordeler over ekko, og de ulike PiCCO-parametrene har potensiell klinisk nytte. PiCCO del 3 tar for seg den potensielle nytten av de andre PiCCO-parametrene og hva slags informasjon som ligger bak. For CO-målingene med PiCCO, se PiCCO del 1 og del 2.
PiCCO-forkortelser
- CO: cardiac output
- GEDVI: global end-diastolic volume index
- ITBVI: intrathoracic blood volume index
- EVLWI: extravascular lung wáter index
- PVPI: pulmonary vascular permeability index
- CFI: cardiac function index
- GEF: global ejection fraction
- CVP: central venous pressure
- SVR : systemic vascular resistance
PiCCO versus ekko
Mange av PiCCO-parametre har en ekkokardiografisk analog, men PiCCO har to store fordeler over ekko. Den første er at målingene er lettere å få etter at kateterne har blitt anlagt. Den andre fordelen er at målingene er mer presise/reproduserbare. Disse to fordelene gjør at monitoring av endringer er lettere med PiCCO. For eksempel, selv om både PiCCO og ekko kan diagnostisere lungeødem (EVLWI med PiCCO; B-linjer med ekko), er PiCCO mer effektiv til å følge endringer over tid.
Ekko har flere fordeler over PiCCO. Den kan oppdage klaffepatologi, skille mellom høyre og venstre ventrikkelfunksjon, oppdage SAM og LVOT obstruksjon. I tillegg er ekko raskere å bruke enn å legge et nytt PiCCO-kateter og gjennomføre de første målingene. Likevel er PiCCO klart raskere for senere oppfølging. Således er ekko et suverent diagnostisk verktøy, mens PiCCO er bedre for monitorering over tid.
GEDVI og ITBVI
Potensiell nytte
Disse parametrene har størst nytte for å utelukke kardiogent sjokk hos pasienter med lavt CO som ikke har innsyn med ekkokardiografi (se CFI og GEF lengre ned). GEDVI under 680 og ITBVI under 850 taler for at pasienten ikke har kardiogent sjokk.
Hvordan det måles: GEDVI og ITBVI beregnes begge fra transpulmonal termodilusjon (TPTD)1, der ITBVI bare er GEDVI ganger 1.25. Fordi målingene baserer seg på TPTD, gjelder de samme begrensningene som ved TPTD for CO-måling (se PiCCO del 1).
Ekkokardiografisk analog: Størrelsen av alle fire hjertekamre + lungekartreet + hele aorta.
Fysiologiske og tekniske aspekter
Disse parametrene reflekterer preload fordi de reflekterer all volumet mellom CVK-spissen til tuppen av PiCCO-kateteret. Dermed forteller de om summen av hjerteskyggen og mediastinum på røntgen thoraks. De skiller ikke mellom høyre eller venstre ventrikkel, heller ikke om volumet kommer fra forstørrede atrier eller aortaaneurysmer.
Den viktigste grunnen til at vi er opptatte av preload er fordi vi tror det kan diagnostisere årsaken til sirkulasjonssvikt og predikere væskerespons. Derfor har disse parametrene fått veldig mye oppmerksomhet fordi de reflekterer preload, men i realiteten har de begrenset nytteverdi av to grunner.
Den første grunnen er at lav preload forekommer ikke bare ved hypovolemi, men også ved vasoplegi der CO er normal eller høy. Dette kaller jeg pseudohypovolemi, fordi alvorlig vasoplege pasienter ser hypovoleme ut med et tomt hjerte på ekko, liten vena cava og høy PPV. Dette er fordi vasoplegi reduserer afterload og forflytter Frank-Starlingkurven mot venstre, noe som tenderer til å redusere preload.
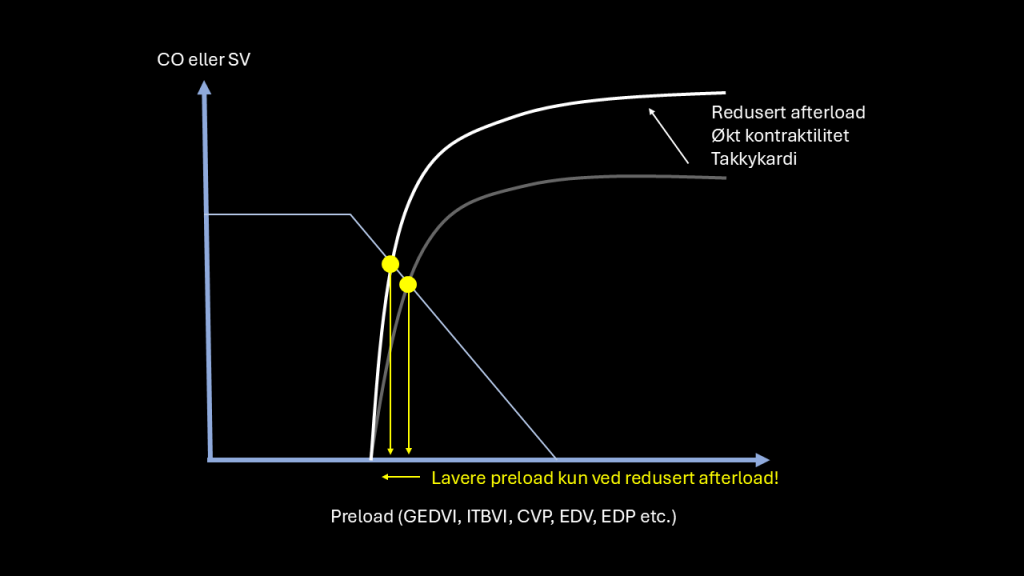
Det som skiller pseudohypovolemi fra ekte hypovolemi er at cardiac output (CO) er normalt eller høyt ved pseudohypovolemi, men den er alvorlig redusert ved ekte hypovolemi. Jeg tror at studier som fokuserer på disse PiCCO-parametrene har ikke vist seg å være nyttig2 fordi denne praksisen fører til at pasienter med lav preload og normal eller høy CO får masse unødvendig væske for å prøve å normalisere preload ved pseudohypovolemi.
Den andre grunnen til at GEDVI/ITBVI har begrenset nytteverdier at selv om de forteller noe om hjertets størrelse og dermed preload, forteller de ikke noe om væskeresponds1. Grunnen til dette er fordi ett øyeblikksbilde på preload (statisk parameter) ikke forteller noe om pasienten er på den bratte delen av Frank-Starling kurven: hvis hjertet fungerer veldig dårlig kan selv lave verdier av preload være på med den flate delen av Frank-Starlingkurven. Ikke bare måler PiCCO-kateteret CO direkte, men en nykalibrert pulskonturanalyse gir kontinuerlig CO, hvilket kan brukes til å måle effekten av væsken eller passiv benheving direkte. En pasient med lav CO og væskeresponder er ekte hypovolem, og normal/høy CO er vasopleg og muligens pseudohypovolem. Således blir GEDVI og ITBVI irrelevante.
ELVWI og PVPI
Potensiell nytte
EVLWI kan brukes til å monitorere utviklingen lungeødem, der EVLWI over 10 mL/kg taler for lungeødem og/eller ARDS-utvikling3 og der fallende EVLWI taler for bedre prognose4.
PVPI over 3 kan brukes til å skille mellom kardiogent lungeødem og ARDS3,5.
Økende EVLWI og PVPI kan være indikasjon på å holde tilbake væske.
Hvordan det måles: EVLWI og PVPI måles begge fra TPTD. Fordi målingene baserer seg på TPTD, gjelder de samme begrensningene som ved TPTD for CO-måling (se PiCCO del 1).
Ekkokardiografisk analog: B-linjer på lungeultralyd.
Fysiologiske og tekniske aspekter
EVLWI er et mål på lungeødem, og PVPI er et mål på hvor mye som skal til for at lungeødemet skjer.
Fordi EVLW baserer seg på TPTD, er tallet avhengig av perfusjon av lungene. Derfor vil alt som reduserer perfusjon vil kunne underestimere EVLWI fra det reelle lungeødemet. Slik reduksjon av lungeperfusjon kan være lungeembolier (som må være store)3, men også overdistensjon av lungene med for høy PEEP. Det motsatte gjelder også: økt PEEP vil faktisk kunne øke EVLWI dersom økt PEEP har positive effekter gjennom rekruttering av lungene, bedring av hypoksisk pulmonal vasokonstriksjon og bedring av lungeperfusjon6.
Pleuravæske skaper ofte usikkerhet ved tolkning av EVLWI, men har lite effekt på målingen fordi pleuravæsken ikke er i «kontakt» med lungeperfusjonen og derfor ikke i kontakt med målingen av EVLWI7.
CFI og GEF
Potensiell nytte
Disse parametrene kan brukes til å gjøre kardiogent sjokk mindre sannsynlig hos pasienter med sirkulasjonssvikt men dårlig innsyn med ekkokardiografi. CFI over 4 og/eller GEF over 18 taler for av adekvat venstre ventrikkelfunksjon på ekko8 og dermed gjøre kardiogent sjokk mindre sannsynlig. CFI under 3.2 taler for at EF er under 35% på ekko9.
Hvordan det måles: CFI beregnes fra CO og GEDVI fra TPTD, der CFI = CO/GEDV og GEF = 4*(slagvolum/GEDVI). Fordi målingene baserer seg på TPTD, gjelder de samme begrensningene som ved TPTD for CO-måling (se PiCCO del 1).
Ekkokardiografisk analog: EF og fractional area change for venstre ventrikkel.
Fysiologiske og tekniske aspekter
CFI og GEF reflekterer hjertets funksjon fordi de inkorporerer CO/slagvolum og preload – de to parametrene som inngår på Frank-Starling kurven. Dette gjør også ekkokardiografiske parametre som LVEF, MAPSE og global longitudinal strain.
Fordi de begge tar utgangspunkt i GEDVI, kan de dermed ikke skille mellom høyre eller venstre ventrikkel, heller ikke om volumet kommer fra forstørrede atrier eller aortaaneurysmer.
Det viktigste er at man ikke tolker CFI og GEF som parametre for kontraktilitet, og ikke prøver å normalisere de med inotropi.
CVP
Potensiell nytte
Økende CVP (over 8-12 mmHg) er et viktig signal på at man må undersøke pasienten nøye med ekko, dobbel blodgass, måle bruktrykk og undersøke respiratorinnstillingene fordi blind bruk av vasopressorer og væske er potensielt skadelig ved økende CVP.
Høy CVP med liten vena cava inferior gir mistanke om intraabdominal hypertensjon fordi buktrykket klemmer sammen vena cava inferior samtidig som det øker trykket i thoraks og dermed CVP.
Høy CVP bør tale for å holde tilbake væske fordi risiko for stuvningsrelatert organskade øker med CVP. CVP over 12-15 mmHg og oliguri taler for stuvningsnyrer/kardiorenal syndrom der korrekt behandling er diuretika og ikke væske.
Hvordan det måles: CVP måles med samme utstyr som en arteriekran, bare at den er koblet på en CVK – helst det gule/brune løpet som er nærmest hjertet.
Ekkokardiografisk analog: Inferiore vena cava diameter i ende-ekspirasjon og kollaps ved inspirasjon.
Fysiologiske og tekniske aspekter
CVP er resultatetet fra mange fysiologiske faktorer (kontraktilitet, afterload, preload, puls, volumstatus, og intratorakale- og intraabdominale trykk), men uavhengig av dette så reflekterer CVP risikoen for stuvningsrelatert organsvikt10.
Normal CVP er 0-5 mmHg. CVP over dette er vanlig, men patologisk fordi det skaper et mottrykk for venøs retur (som ved obstruktiv sjokk). Små endringer i transduseren kan gi betydelige målefeil i CVP fordi det absolutte tallet er så lavt10.
CVP deler begrensninger med GEDVI i form av at begge er statiske parametre på preload, bare CVP er trykk og GEDVI er volum10. Derfor har CVP også begrensninger ved å spå væskerespons og skille mellom ekte hypovolemi fra pseudohypovolemi10.
CVP-kurvens utseende kan gi ekstra informasjon om fysiologi, som ved Doppler av levervenen11.
SVR
Potensiell nytte
Lav SVR hos pasienter med høyt NorA-behov kan brukes til å demonstrere for alle at pasienten er vasopleg og dermed kanskje ikke gagnes av mer væske.
SVR er muligens nyttig for å følge kartonus over tid, men dette er usikkert.
Hvordan det måles: SVR måles aldri, men beregnes som SVR = 79.9*(MAP-CVP)/CO.
Ekkokardiografisk analog: Ingen, men kan beregnes hvis CO måles med ekko.
Fysiologiske og tekniske aspekter
SVR er et grovt, men unøyaktig mål på kartonus som medfører mange misforståelser. Bisarre og alvorlige feilslutninger kan forekomme hvis man tolker relasjonen mellom SVR og kartonus for bokstavelig. For eksempel vil normal eller høy CO med MAP på 65 kunne føre til lav SVR som kan feiltolkes som indikasjon for å øke vasopressorer til tross for et adekvat MAP – dette er sannsynligvis skadelig. Det motsatte gjelder også: lav CO med normal MAP på 80 føre til høy SVR som kan feiltolkes som indikasjon for vasodilatatorer – dette gir kun mening hvis kilden til lav CO er venstre ventrikkelsvikt, men vil gi katastrofal sirkulasjonssvikt dersom årsaken til lav CO er noe annet (hypovolemi, høyre ventrikkelsvikt, osv).
Noen tolker SVR som venstre ventrikkels afterload, men dette er i beste tilfelle kun delvis rett. Afterload defineres av veggstress som definert av Laplace12. SVR har en relasjon til afterload fordi for den samme CO vil høy SVR føre til høyere blodtrykk og dermed systolisk veggstress. For eksempel er ikke veggstress/afterload alvorlig forhøyet hos hypovoleme pasienter med veldig høy SVR og samtidig relativt lav MAP.
Konklusjon
PiCCO brukes til å følge et par andre parametre som er potensielt nyttige, men CO er den viktigste. Preload-parametre har lenge vært i fokus, men har begrenset nytte på grunn av manglende effekt til å spå væskerespons og fenomenet pseudohypovolemi. Selv om monitorering kan gi nyttig informasjon, bør man sjeldent sikte på å normalisere ett parameter fordi de påvirkes av mange andre faktorer enn det man prøver å korrigere.
Videre lesing
Monnet, X., Teboul, JL. Transpulmonary thermodilution: advantages and limits. Crit Care 21, 147 (2017). https://doi.org/10.1186/s13054-017-1739-5
Referanser
1. Monnet X, Teboul JL. Transpulmonary thermodilution: advantages and limits. Crit Care. 2017;21(1):147. doi:10.1186/s13054-017-1739-5
2. Zhang Z, Ni H, Qian Z. Effectiveness of treatment based on PiCCO parameters in critically ill patients with septic shock and/or acute respiratory distress syndrome: a randomized controlled trial. Intensive Care Med. 2015;41(3):444-451. doi:10.1007/s00134-014-3638-4
3. Jozwiak M, Teboul JL, Monnet X. Extravascular lung water in critical care: recent advances and clinical applications. Ann Intensive Care. 2015;5(1):38. doi:10.1186/s13613-015-0081-9
4. Tagami T, Nakamura T, Kushimoto S, et al. Early-phase changes of extravascular lung water index as a prognostic indicator in acute respiratory distress syndrome patients. Ann Intensive Care. 2014;4(1):27. doi:10.1186/s13613-014-0027-7
5. Monnet X, Anguel N, Osman D, Hamzaoui O, Richard C, Teboul JL. Assessing pulmonary permeability by transpulmonary thermodilution allows differentiation of hydrostatic pulmonary edema from ALI/ARDS. Intensive Care Med. 2007;33(3):448-453. doi:10.1007/s00134-006-0498-6
6. Gavelli F, Teboul JL, Azzolina D, et al. Transpulmonary thermodilution detects rapid and reversible increases in lung water induced by positive end-expiratory pressure in acute respiratory distress syndrome. Ann Intensive Care. 2020;10(1):28. doi:10.1186/s13613-020-0644-2
7. Saugel B, Phillip V, Ernesti C, et al. Impact of large-volume thoracentesis on transpulmonary thermodilution–derived extravascular lung water in medical intensive care unit patients. J Crit Care. 2013;28(2):196-201. doi:10.1016/j.jcrc.2012.05.002
8. Combes A, Berneau JB, Luyt CE, Trouillet JL. Estimation of left ventricular systolic function by single transpulmonary thermodilution. Intensive Care Med. 2004;30(7):1377-1383. doi:10.1007/s00134-004-2289-2
9. Jabot J, Monnet X, Bouchra L, Chemla D, Richard C, Teboul JL. Cardiac function index provided by transpulmonary thermodilution behaves as an indicator of left ventricular systolic function. Crit Care Med. 2009;37(11):2913-2918. doi:10.1097/CCM.0b013e3181b01fd9
10. De Backer D, Vincent JL. Should we measure the central venous pressure to guide fluid management? Ten answers to 10 questions. Crit Care. 2018;22(1):43. doi:10.1186/s13054-018-1959-3
11. Volum intoleranse – CVP er verdifullt – Dritsyk. March 23, 2021. Accessed November 29, 2024. https://www.dritsyk.no/volum-intoleranse-cvp-er-verdifullt/
12. Norton JM. Toward consistent definitions for preload and afterload. Adv Physiol Educ. 2001;25(1):53-61. doi:10.1152/advances.2001.25.1.53